A cura di Alice Galesi
Background
La somministrazione di farmaci aerosolizzati è comunemente utilizzata per il trattamento di malattie polmonari [1], (ad esempio, asma, disturbi polmonari ostruttivi, fibrosi cistica, ipertensione arteriosa polmonare, malattia polmonare infettiva) [2]. L’uso dell’aerosolterapia durante la ventilazione meccanica è frequente per la somministrazione di broncodilatatori e steroidi nella broncopneumopatia ostruttiva e meno frequente per la somministrazione di antibiotici nella polmonite associata al ventilatore e nelle infezioni tracheobronchiali in pazienti con fibrosi cistica [1]. L’implementazione ottimale della terapia inalatoria nel paziente ventilato risulta complessa a causa di diversi dispositivi di aerosolizzazione, impostazioni ventilatorie, molecole e indicazioni terapeutiche [1,3]. La somministrazione di aerosol durante ventilazione meccanica è studiata da più di 30 anni, eppure non è stato individuato nessun metodo standard per l’erogazione [4]. Inoltre, da una survey internazionale emerge che le conoscenze scientifiche sembrano essere applicate raramente e si riportano anche delle pratiche potenzialmente pericolose [1]. I problemi legati all’aerosolterapia possono essere affrontati attraverso programmi educativi e di ricerca centrati sulla diffusione delle conoscenze facilmente attuabili nella pratica clinica [1].
Fattori che differenziano l’erogazione di aerosol durante ventilazione meccanica invasiva
Una serie di fattori influenza la deposizione polmonare dei farmaci nebulizzati durante la ventilazione meccanica: variabili relative al tipo di nebulizzatore, al ventilatore, al circuito del ventilatore, al farmaco e al paziente (Fig 1.) [3,5].
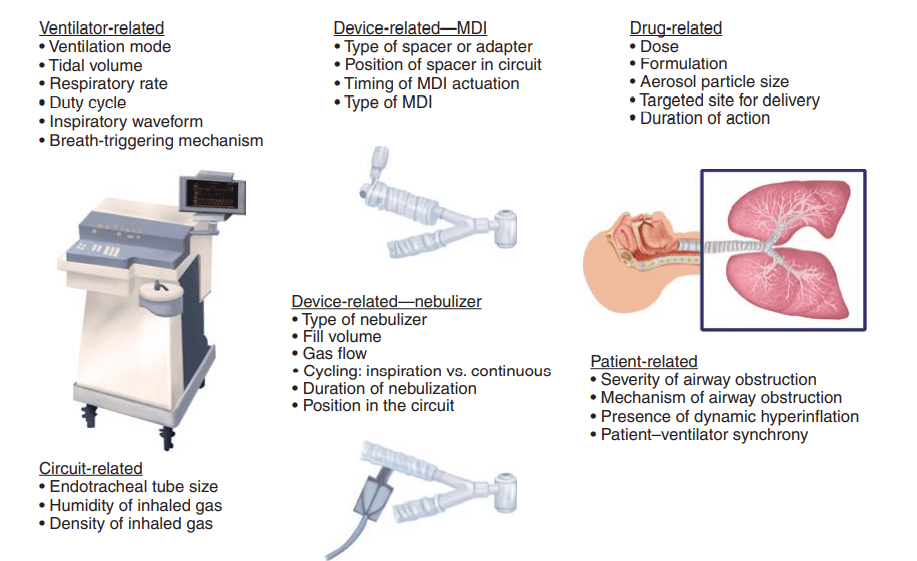
Variabili relative al dispositivo generatore di aerosol
L’erogazione di aerosol durante ventilazione meccanica è influenzata fortemente dal dispositivo impiegato per generare aerosol [3,5]. Sono disponibili diversi nebulizzatori (a getto, a ultrasuoni, a rete vibrante), o inalatori pressurizzati predosati (pMDI) con distanziatore e inalatori a nebbia morbida (SMI) [6].
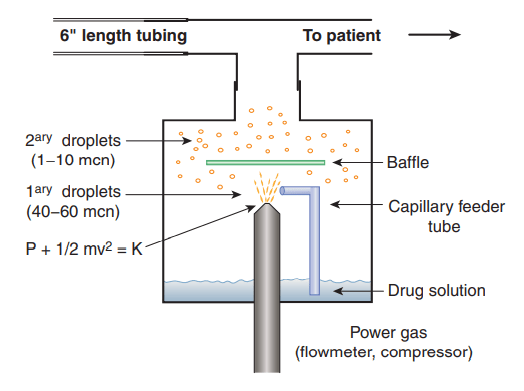
Nebulizzatore pneumatico a getto o Jet Nebulizer (JN)
Il nebulizzatore a getto eroga gas pressurizzato mediante un ugello per convertire la soluzione liquida in aerosol. L’aria pressurizzata fluisce attraverso la soluzione liquida per creare goccioline [10] e un deflettore frapposto al flusso di aerosol genera particelle microscopiche [8,10]. Ogni modello di nebulizzatore jet è progettato per lavorare al meglio con uno specifico flusso, da 2 a 8 l/min; flussi e pressioni inferiori aumentano la grandezza delle particelle [10]. I ventilatori di nuova generazione consentono la nebulizzazione deviando una frazione del flusso inspiratorio per alimentare il nebulizzatore a getto durante l’inspirazione [6]. Collegando il nebulizzatore ad una fonte di gas esterno durante ventilazione meccanica, non è possibile controllare accuratamente il tidal volume, esponendo il paziente a potenziali pericoli [1]. Sebbene un aerosol sincronizzato con la fase inspiratoria possa essere meno dannoso per la ventilazione meccanica, non è chiaro se migliora l’erogazione di aerosol [6,8]. La pressione fornita dal ventilatore, durante la fase inspiratoria (<15 libbre per pollice quadrato [psi]), rispetto a quella fornita da fonte di gas esterno (≥50 psi) potrebbe diminuire l’efficienza di alcuni nebulizzatori [5]. Un nebulizzatore operante ad una pressione inferiore può generare particelle il cui diametro non è ottimale per la deposizione di aerosol. Tuttavia, durante il funzionamento intermittente si riducono al minimo gli sprechi di aerosol durante la fase espiratoria del ciclo respiratorio [5]. A causa di risultati contrastanti nella ricerca precedente, vi è una significativa necessità di ulteriori ricerche cliniche su questo argomento [8]. Inoltre, per aumentare la quantità di farmaco nebulizzato si raccomanda di utilizzare un volume di riempimento di 4 -5 ml, perché i nebulizzatori jet presentano un volume residuo tra 0.5 e 2 ml [10]. La grandezza delle particelle e il volume residuo possono essere influenzate dall’umidità e dalla temperatura: l’evaporazione dell’acqua può ridurre la temperatura dell’aerosol aumentando la viscosità della soluzione liquida e riducendo l’output di farmaco [5,8,10]. I nebulizzatori a getto sono i dispositivi più frequentemente durante ventilazione meccanica [1], perché di semplice utilizzo e relativamente poco costosi [6]. Gli svantaggi sono la necessità di una fonte di alimentazione, lunghi tempi di funzionamento, montaggio e pulizia dell’attrezzatura, oltre che differenza di prestazioni tra i nebulizzatori [5].
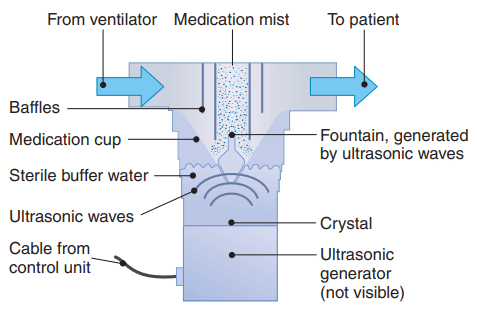
Nebulizzatore a ultrasuoni o Ultrasonic Nebulizers (USN)
Il nebulizzatore a ultrasuoni impiega un trasduttore piezoelettrico per convertire un segnale elettrico in vibrazioni acustiche ad alta frequenza (da 1,2 a 2,4 MHz) [6]; le vibrazioni sono trasmesse alla soluzione liquida creando un’onda stazionaria che genera particelle di aerosol (da 5,5 a 7 μm) [6]. USN furono introdotti come nebulizzatori di grande volume ed utilizzati per la somministrazione di soluzione ipertonica al fine di promuovere l’espettorazione [10]. USN di piccolo volume sono attualmente disponibili per la somministrazione di broncodilatatori [10], ma non comunemente impiegati durante ventilazione meccanica perché ingombranti e costosi [6]. Inoltre, i nebulizzatori ad ultrasuoni sono inefficienti per le sospensioni aerosolizzanti (es. i corticosteroidi) per via di particelle di dimensioni maggiori [6] e tendono a riscaldare i farmaci rischiando di degradarli [6,8,10]. La deposizione polmonare di farmaco erogato è maggiore rispetto a quella ottenuta coi nebulizzatori a getto [9] e con tempi di erogazione inferiori [5] ma, costo, dimensione e inefficienza nella nebulizzazione ne precludono l’utilizzo in terapia intensiva [8].
Nebulizzatori a membrana vibrante o Vibrating Mesh Nebulizers (VMN)
I VMN sono attivi o passivi; quelli attivi hanno una piastra vibrante con aperture multiple, quelli passivi utilizzano un corno a ultrasuoni per spingere il fluido attraverso una membrana [8,10]. Attualmente solo i VMN attivi sono disponibili per la nebulizzazione durante ventilazione invasiva [6]. La piastra è dotata di un migliaio di fori a forma d’imbuto e l’energia elettrica applicata ad un elemento piezo-ceramico la fa vibrare ad una frequenza di circa 130 kHz, in modo da convogliare il fluido attraverso le aperture e creare delle goccioline di 3 e 5 µm [6,10]. I tempi di trattamento dei VMN sono rapidi [8], con volume residuo minimo (0,1– 0,5 ml) [6,10] e hanno la capacità di nebulizzare una varietà di soluzioni e sospensioni [8]. Inoltre, i VMN funzionano elettricamente senza una fonte di gas esterna al circuito chiuso del ventilatore e non aggiungono molto calore al farmaco, riducendo così il rischio di denaturazione delle proteine [8]. Tuttavia, i fori della piastra potrebbero intasarsi con alcune sospensioni o farmaci viscosi e può essere difficile determinarlo dall’erogazione del dispositivo [8]. Il VMN è associato ad un’efficienza maggiore rispetto a JN e USN [6,8], pertanto, potrebbe essere necessario che le dosi di farmaco siano regolate per eliminare i potenziali effetti avversi legati ad una dose eccessiva [8].

Inalatori pressurizzati predosati o pressurized metered-dose inhaler (pMDI)
Il pMDI utilizza un propellente pressurizzato per erogare una dose misurata di aerosol attraverso un ugello di nebulizzazione [6,8]. Il pMDI è composto da un serbatoio in alluminio [8], dal propellente, dal farmaco, da una valvola dosatrice e dall’attivatore [8,10]. Il serbatoio contiene una miscela pressurizzata di propellenti (clorofluorocarburi [CFC] o idrofluoroalcano [HFA]), conservanti, agenti aromatizzanti e dosi di farmaco [8]. Il farmaco rappresenta circa l’1% del contenuto totale [5], mentre il propellente rappresenta l’80% della miscela [10]. La compressione del serbatoio [10] determina il rilascio della miscela attraverso una valvola dosatrice e uno stelo, che si inseriscono all’interno di un attuatore [5], comunemente chiamato ‘boot’ (stivaletto) [10]. Il volume della valvola dosatrice varia da 25 a 100 μL e assicura dai 50 μL ai 5 mg di farmaco, ad ogni attivazione in relazione al tipo di composizione farmacologica [10]. L’espulsione della sospensione liquida genera un “pennacchio”, che i propellenti vaporizzano entro 20 ms [6].
La dimensione delle particelle prodotte dal pMDI è inferiore a 5 μm. Il funzionamento del pMDI e la dose rilasciata sono influenzati da alcuni fattori. Questi includono: il priming, l’agitazione del pMDI e i tempi di attivazione [8,10]. I farmaci nelle formulazioni per pMDI rimangono separati dai propellenti, solitamente quando il dispositivo è nuovo o non utilizzato da tempo (ad es. per una notte) [8,10]; pertanto è consigliato, prima del primo trattamento e ogni volta quando non è stato utilizzato per 24 ore, [8] agitare il pMDI affinché la sospensione nella bomboletta si mescoli [10] e rilasciare uno o più spray a vuoto [8] al fine di riempire la valvola dosatrice dopo un’adeguata miscela [10]. Sui tempi di attivazione la letteratura dice che il ritardo tra l’attuazione di una dose e l’inspirazione, diminuisce la deposizione di aerosol dovuta alla sedimentazione e alla carica elettrostatica [8]. Inoltre, per non causare una riduzione della dose emessa le aziende farmaceutiche raccomandano una pausa di 1 minuto tra diverse attuazioni con il pMDI [8], perché due o più azionamenti rapidi di un pMDI possono portare ad una diminuzione della somministrazione di farmaci a causa della turbolenza e dell’unione delle particelle [8,10].
Durante la ventilazione meccanica affinché un pMDI usuale possa essere impiegato, il contenitore deve essere rimosso dall’attuatore e collegato al circuito del ventilatore con un adattatore diverso [5,11]. In commercio sono disponibili diversi tipi di distanziatori [11], tra cui: i dispositivi a gomito collegati al tubo endotracheale, i dispositivi in-line (unidirezionali o bidirezionali [5]) posizionati nell’arto inspiratorio del circuito del ventilatore e le camere distanziatrici, che comprendono i distanziatori cilindrici e i dispositivi reservoir (Fig. 5) [11].
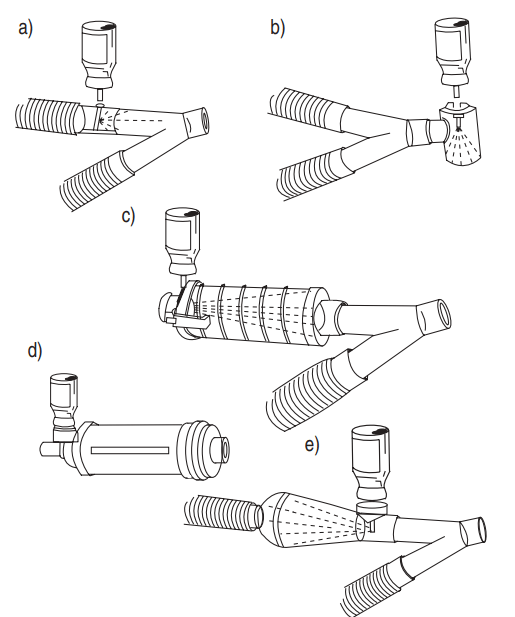
Le differenze nel design e nelle dimensioni dei distanziatori sono altri fattori che influiscono sulla deposizione di aerosol durante ventilazione meccanica [8], e quindi sulla dose necessaria a produrre un effetto terapeutico [5]. I distanziatori possono essere costruiti di plastica, materiale elettrostatico o di metallo, un materiale non elettrostatico. Se un distanziatore è prodotto di plastica, i farmaci aerosolizzati vengono attratti dalle pareti dell’adattatore, diventando indisponibili per l’inalazione [12]. L’apparecchio che non presenta cariche elettrostatiche, consente ai farmaci aerosolizzati di rimanere sospesi per periodi più lunghi all’interno del distanziatore. Quindi, non c’è sostanziale perdita di farmaco sulle pareti di metallo o nei distanziatori non elettrostatici anche quando l’inalazione è ritardata di 2–5 s [8]. Immergendo i distanziatori di plastica, una volta alla settimana, in acqua con detergente e lasciandoli asciugare da soli (senza strofinarlo con un panno), è possibile ridurre il fenomeno delle cariche elettrostatiche [12]. Si consiglia inoltre di eseguire il priming dell’apparecchio (con 10 spruzzi a vuoto al suo interno), quando lo si utilizza per la prima volta, in modo da creare una pellicola antistatica sulle pareti [12]. I distanziatori più voluminosi trattengono più aerosol erogato da pMDI rispetto ai distanziatori di piccolo volume, diminuendo la quantità di aerosol disponibile presso il pMDI [8]. Infine, è importante abbinare le dimensioni dello stelo del contenitore pMDI con il distanziatore adeguato per collegarsi ai circuiti del ventilatore perché la dimensione dello stelo del contenitore differisce per ogni pMDI e l’efficienza di erogazione di aerosol è influenzata dal suo posizionamento nel distanziatore [8]. È stato dimostrato che l’impiego di una camera distanziatrice con un pMDI in un circuito di ventilazione ha prodotto un effetto terapeutico maggiore rispetto a un adattatore a gomito o ad un distanziatore in-line unidirezionale [5,11]. L’efficienza di un distanziatore in linea bidirezionale, nello studio di Rau et al, è risultato superiore a quello di un distanziatore in linea unidirezionale [6] ed era paragonabile a quello ottenuto con le camere distanziatrici, [6] anche se le prestazioni del distanziatore bidirezionale non sono state stabilite in studi clinici. Pertanto, un dispositivo distanziatore con una camera posizionata a distanza dal tubo endotracheale è il metodo preferito per la somministrazione di un aerosol mediante MDI in un paziente ventilato meccanicamente [11].
Inalatori a nebbia morbida o soft mist inhaler (SMI)
Gli inalatori a nebbia morbida (SMI) sono una nuova generazione di inalatori predosati, che utilizzano la forza meccanica di una molla compressa [13]. Quando la molla viene rilasciata [13], il volume misurato di farmaco passa attraverso due ugelli, generando due getti che convergono in un punto specifico [13]. Ne risulta un aerosol di particelle fini, erogato meno rapidamente degli erogatori tradizionali (tra 1,0 e 1,5 s). La deposizione polmonare risulta essere più profonda e uniforme [6]. Ricerche precedenti hanno rilevato che gli SMI possono generare aerosol di farmaci con un diametro aerodinamico mediano di massa (MMAD) < 5 mm e una frazione di particelle fini > 60 [13], indipendentemente dallo sforzo inspiratorio [6]. Sono pochi gli studi sui metodi di somministrazione della terapia inalatoria attraverso SMI in un paziente intubato, perché fornire una prestazione efficace di questo dispositivo durante ventilazione meccanica risulta essere impegnativo [13]. Per utilizzare in modo sicuro SMI durante ventilazione meccanica sono necessarie delle modifiche o degli adattatori che colleghino il device al circuito del ventilatore. Tuttavia, non esiste un modo consigliato per utilizzare SMI durante la ventilazione meccanica e l’adattatore SMI non è disponibile in tutti i paesi. Nello studio di Fang e colleghi la dose inalata tramite tubo endotracheale con un adattatore commerciale è risultata più alta con SMI azionato durante l’espirazione, ma ancora molto inferiore alla dose inalata con respirazione spontanea (22,08%) [14]. Questo ha sollevato dubbi sulla possibilità di ottenere una somministrazione di farmaco sufficiente per giustificarne l’uso durante la ventilazione meccanica [6].
RIASSUMENDO
JN, VMN e pMDI sono i dispositivi aerosol più comunemente usati durante la ventilazione invasiva [6]. Gli studi hanno riportato dosi di farmaco erogate di circa il 3–5% della dose totale somministrata per i JN, il 17–35% per i VMN e il 10–20% per i pMDI con distanziatore. Il nebulizzatore a rete vibrante ha attirato l’interesse, nella somministrazione della terapia inalatoria al paziente ventilato, per la maggior dose di farmaco erogata, l’assenza di una fonte di gas esterna e per la sua durata sul circuito ventilatorio, di massimo 28 giorni [6].
Le altre variabili che influenzano la deposizione polmonare dei farmaci nebulizzati durante ventilazione meccanica (quelle relative al ventilatore, al circuito del ventilatore, al farmaco e al paziente) verranno approfondite nella seconda parte.
Un caro saluto a tutti
Alice Galesi
Bibliografia
- Ehrmann S, Roche-Campo F, Sferrazza GF, et al. Aerosol therapy during mechanical ventilation: an international survey For the REVA research network. Intensive Care Med, 2013; 39(6):1048-56.
- Buddiga P, Use of Metered Dose Inhalers, Spacers, and Nebulizers, Apr. 12/2020. https://www.medscape.com. Consultato 01/04/2022.
- Arzu A, Atalay OT, Harwood R, et al. Influence of nebulizer type, position, and bias flow on aerosol drug delivery in simulated pediatric and adult lung models during mechanical ventilation. Respir Care,2010;55(7):845-51.
- Ashraf S, McPeck M, Cuccia AD, et al. Comparison of Vibrating Mesh, Jet, and Breath-Enhanced Nebulizers During Mechanical Ventilation. Respiratory Care,2020.
- Tobin MJ. Principles and practice of mechanical ventilation. New York: McGraw Hill; 2013.
- Hui-Ling L, Fink JB, Huiqing G. Aerosol delivery via invasive ventilation: a narrative review. Ann Transl Med, 2021; 9(7):588.
- Miller D, Amin M, Palmer LB, et al. Aerosol delivery and modern mechanical ventilation: in vitro/in vivo evaluation. Am J Respir Crit Care Med, 2003;168:1205-9.
- Arzu A. Aerosol therapy in pulmonary critical care. Respir Care, 2015;60:858-874.
- Harvey CJ, O’Doherty MJ, Page CJ, et al. Comparison of jet and ultrasonic nebulizer pulmonary aerosol deposition during mechanical ventilation. Eur Respir J 1997;10: 905-9.
- Associazione riabilitatori dell’insufficienza respiratoria, Guida ai dispositivi per Aerosolterapia II edizione, Unità spinale ASST, Grande Ospedale Metropolitano, Niguarda (MI), ultimo update 2019. https://www.arirassociazione.org/guida-ai-dispositivi-per-aerosolterapia-ii-edizione. Consultato 01/04/2022.
- Dhand R, Tobin MJ. Bronchodilator delivery with metered-dose inhalers in mechanically-ventilated patients. Eur Respir J,1996;9(3):585-95.
- Commissione Asma della Società Italiana di Allergologia ed Immunologia Pediatrica, Linee Guida pratiche basate sull’evidenza sull’uso dei distanziatori nel trattamento dell’asma bronchiale infantile, edizione 2008. https://www.siaip.it/upload/611.pdf. Consultato 01/04/2022.
- Wei-Ren K, Wei-Jhen W, LinTzu-Hsuan, et al. In Vitro Evaluation of Aerosol Performance and Delivery Efficiency During Mechanical Ventilation Between Soft Mist Inhaler and Pressurized Metered-Dose Inhaler. Respiratory Care July, 2020;65(7):1001-1010.
- Fang TP, Chen YJ, Yang TM, et al. Optimal connection for Tiotropium SMI delivery through mechanical ventilation: an in vitro study. Pharmaceutics, 2020;12:291.
- Roy A, Dean R et al. Aerosol Delivery Devices for Obstructive Lung Diseases. Respir Care,2018;63(6):708-733.